Une histoire d’eau, de sels et de pores
Un matériau poreux est un milieu hétérogène où sont associées 3 phases : une phase solide, une phase liquide et une phase gazeuse.
C’est en solution que les sels peuvent pénétrer au sein d’un tel matériau (sur ce sujet voir notre article la molécule d’eau et notamment le paragraphe sur l’eau comme solvant). La dégradation des matériaux poreux par les sels est donc commandée par le comportement du système sels-eau, comportement lui-même dicté par le transport de l’eau au sein du substrat poreux.
L’eau pénètre un matériau poreux soit sous forme liquide soit sous forme vapeur. Liquide, l’eau s’y déplace soit par capillarité soit par infiltration : par capillarité, l’eau se déplace vers les zones où son énergie libre est la plus basse ; par infiltration, l’eau se déplace sous l’effet de la gravité.
L’eau vapeur, elle, pénètre le substrat poreux soit par condensation à la surface ou à l’intérieur du substrat, soit par hygroscopicité (absorption ou adsorption des molécules d’eau).
|
Nature des sels La majorité des sels résulte de la combinaison de cinq anions : CO32- (carbonate), SO42- (sulfate), Cl- (chlorure), NO3- (nitrate) et C2O42- (oxalate) et cinq cations : Na+ (sodium), K+ (potassium), Ca2+ (calcium) Mg2+ (magnésium) et NH4+ (ammonium). |
Transport d’eau au sein du substrat poreux
Si le matériau poreux contient en quantité suffisante de l’eau sous état liquide pour que son réseau poreux soit interconnecté, l’eau se transportera majoritairement par capillarité sous l’influence d’un gradient de teneur en eau. Si le matériau n’est que partiellement saturé, l’eau se transportera sous forme vapeur par diffusion.
Ce transport d’eau véhicule au sein du substrat les sels qui y sont dissous sous forme d’ions. Le transport d’ions s’effectue lui-même par advection (il s’agit en fait du mouvement de l’eau elle-même) ou par diffusion : la diffusion des ions correspond au mouvement des ions sous l’effet d’un gradient de concentration ionique. La diffusion est un phénomène qui tend à égaliser la concentration des ions en tout point d’une solution.
Le séchage est un évènement qui correspond à la diminution de la teneur en eau du substrat par le transfert de l’eau vers l’air ambiant.
|
Solubilité La solubilité est la quantité maximale de produit que l’on peut dissoudre à une température déterminée dans une quantité de solvant donnée. Cette quantité varie avec la température. Le produit de solubilité permet de classer les composés en fonction de leur concentration limite de précipitation. Plus ce produit est faible, moins la substance est soluble. La solubilité des sels est donc variable : 360 g de NaCl (sel de table) peuvent être dissous dans un litre d’eau, mais seulement 2 g de CaSO4 (gypse). Lors de l’évaporation d’une solution, les sels les moins solubles précipitent d’abord. Ainsi, dans une remontée capillaire, les sels les moins solubles précipitent le plus tôt, c’est-à-dire au point le plus bas, soit au plus près de la source d’humidité. La séquence classiquement observée verra se déposer dans l’ordre, depuis le bas vers le haut, les carbonates, les sulfates, puis les chlorures, bien que la réserve disponible en ions alcalins notamment puisse redéfinir l’ordre de précipitation des sels selon les concentrations résiduelles au fil de l’ascension capillaire des solutions. A noter également le rôle des interventions microbiologiques dans ces processus de cristallisation. |
Précipitation et cristallisation des sels
Dans une solution aqueuse de chlorure de sodium, par exemple, à partir d’une certaine quantité de sel et à température constante, le sel ne se dissout plus. La solution est alors dite saturée. S’il arrive que cette solution contienne plus de soluté qu’elle ne peut en dissoudre normalement, le seuil de sursaturation est atteint. La précipitation peut être considérée comme le phénomène inverse de la dissolution : ainsi, l’évaporation provoque une diminution du volume de solvant, volume dont la concentration en solutés augmente donc. Quand cette concentration dépasse la solubilité des solutés, le seuil de sursaturation est atteint et les solutés précipitent.
La plupart des sels ont une solubilité qui croit avec la température. Si une solution se refroidit, alors leur solubilité diminue. Une solution à saturation passera alors en situation de sursaturation et la précipitation des sels deviendra possible.
La sursaturation peut donc être considérée comme la force motrice du processus de cristallisation.
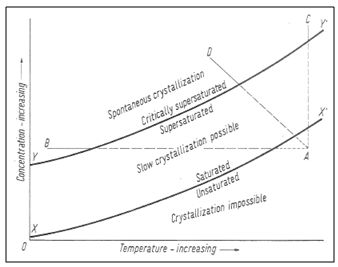
| Courbe de concentration en fonction en fonction de la température. La sursaturation peut être obtenue par refroidissement (A-B) par augmentation de la concentration (A-C), par combinaison des deux (A-D). in Winkler, 1973, Stone : Properties, Durability in Man’s Environment |
