La pâte de ciment durcie est constitué de C-S-H considérés collectivement comme un gel, de cristaux de Portlandite Ca(OH)2, de quelques composants mineurs et enfin, de grains de ciment non hydratés. Le reste est constitué de vides qui, dans la pâte fraîche, sont remplis d’eau. Ces vides sont appelés pores capillaires. Mais à l’intérieur même du gel, il existe aussi des vides interstitiels appelés pores de gel.
L’eau, composant de la pâte de ciment, est aussi importante par sa présence, que par sa transformation et même par sa disparition, dont les vides, dans la matrice, sont la trace…
Le rapport eau/ciment : hydratation
Pendant l’hydratation, qui commence dans une suspension colloïdale, la surface de la phase solide croît et une partie de l’eau libre est adsorbée à sa surface. Dans un milieu confiné, à l’abri d’apports ou de départs d’eau, les réactions d’hydratation consomment une grande part de la quantité d’eau, ce qui implique une diminution de l’humidité relative de la pâte. Ce phénomène est reconnu sous le nom d’autodessication.
Cette autodessication ralentit progressivement l’hydratation dans la mesure où le gel de C-S-H ne se forme précisément qu’en présence d’eau.
La masse d’eau chimiquement liée dans les hydrates lors de l’hydratation étant difficile à déterminer, il est plus sûr de prendre en compte l’eau non évaporable, qui correspond en général à 23% de la masse de ciment anhydre.
| Précision : « la quantité d’eau non évaporable augmente avec l’hydratation, mais, dans une pâte saturée, l’eau non évaporable ne peut jamais représenté plus de la moitié de l’eau totale. Dans le cas d’un ciment bien hydraté, l’eau non évaporable représente environ 18% de la masse des matériaux anhydres ; cette proportion s’élève à 23% pour un ciment complètement hydraté. » A. M. Neville citant Lea, The Chemistry of Cement, 1970 (1) |
Les produits d’hydratation occupent un volume supérieur au volume absolu du ciment anhydre, et inférieur à la somme des volumes du ciment et de l’eau non évaporable d’environ 0,254 fois le volume de cette eau. Muni de ces données, A. M. Neville (1) calcule les volumes mis en jeu pour 100 g de ciment anhydre, calcul qu’il récapitule ainsi :
| Masse de ciment anhydre | 100 g |
| Masse de l’eau combinée (ou non évaporable) | 23 g |
| Volume de l’eau du gel | 19 g |
| Eau total du mélange | 42 ml |
| Rapport eau/ciment massique | 0,42 |
| Rapport eau/ciment volume | 1,32 |
| Volume ciment hydraté | 67,9 |
| Volume initial ciment+eau | 73,8 |
| Diminution volume liée à l’hydratation | 5,9 ml |
Il tire de ce tableau la représentation graphique suivante :
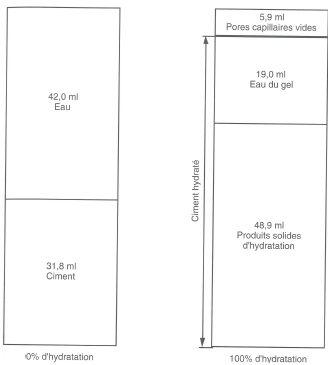
Représentation schématique de la variation du volume d’une pâte de ciment de rapport eau/ciment de 0,42
Cette représentation montre que la diminution de volume due à l’hydratation notée dans le tableau correspond aux pores capillaires vides répartis dans la pâte de ciment hydraté. Comme le gel ne peut se former que s’il y a suffisamment d’eau à la fois pour les réactions d’hydratation et pour le remplissage des pores, si la quantité d’eau initalement ajoutée avait été inférieure à 42 ml, l’hydratation n’aurait pu être complète.
Il convient de noter ici que l’eau des pores de gel, chimiquement ou physiquement adsorbée, ne peut migrer vers les pores de capillarité.
Sans apport d’eau extérieure, l’hydratation s’arrête lorsque l’eau combinée atteint environ la moitié de l’apport d’eau initial.
Les calculs sur les volumes indiquent aussi que si le rapport eau/ciment massique est inférieur à 38%, l’hydratation complète est impossible, du fait que le volume disponible est insuffisant pour contenir la totalité des produits d’hydratation.
| C’est Le Chatelier (1) qui, en 1900, met en évidence la contraction de la matrice cimentaire lors du processus d’hydratation. Ce phénomène porte donc le nom de contraction Le Chatelier : cette contraction découle du fait que le volume des hydrates formés est inférieur à la somme des volumes des constituants réactifs (l’eau et le ciment). Dans la pâte de ciment au très jeune âge, cette contraction peut s’effectuer librement. Après la prise, le durcissement de la pâte empêche ce phénomène : la contraction met en jeu des tensions capillaires au sein du ciment durci, qui aboutissent localement à une vaporisation de la solution interstitielle. Ce retrait, appelé endogène en raison de son lien avec les réactions chimiques inhérentes au matériau, est négligeable pour des mortiers dont le rapport eau/ciment est élevé. Il n’en est pas de même pour les matrices des bétons à hautes et très hautes performances, à faible rapport eau/ciment : la réduction de la porosité initiale réactive ce risque de retrait endogène, qui peut se manifester alors par une fissuration précoce.(1) Henri Le Chatelier : Sur le changement de volume qui accompagne le durcissement des ciments. Bulletin de la Société d’encouragement pour l’industrie nationale, 5e série, tome 5, pp. 54-57. |
Rapport eau/ciment : résistance à la compression
Le pourcentage de vide dans le béton influe directement et défavorablement sur sa résistance à la compression. Compte tenu du fait que la compacité du béton est déterminée à la fois par son serrage et, nous venons de le voir, par le rapport eau/ciment, ce rapport important pour l’hydratation ne l’est pas moins pour la résistance mécanique du béton. Cette résistance est inversement proportionnelle au rapport eau/ciment. C’est ce qu’indique la règle formulée empiriquement par René Féret dès 1896 ( ! ) :
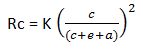 ou Rc est la résistance du béton
ou Rc est la résistance du béton
c = ciment
e = eau
v = air
et k est une constante.
Cette formule montre l’intérêt que présente la diminution de la quantité d’eau de gâchage et d’air, pour réduire la porosité, réduction dont la conséquence est l’élévation de la résistance.
L’introduction des superplastifiants a permis, une réduction significative de l’eau de gâchage… Ce sera l’objet de l’un des prochains épisodes de notre feuilleton sur l’eau.
Rappel de la typologie de l’eau présente dans la pâte de ciment hydraté
L’eau libre
Cette eau n’est pas soumise aux effets de surface des solides. Elle se trouve dans les pores capillaires.
L’eau adsorbée
Cette eau est soumise aux effets de surface des solides.
Elle peut être adsorbée physiquement : elle est alors soumise aux forces d’attraction de type Van der Waals.
Elle peut être adsorbée chimiquement : des électrons sont mis en commun entre l’eau et la surface solide. La structure de la molécule d’eau est donc modifiée par rupture de la liaison covalente O-H
L’eau combinée
L’eau peut être chimiquement combinée : elle entre dans les réactions chimiques d’hydratation pour former des C-S-H, la Portlandite ou de l’ettringite.
L’eau des pores de gel
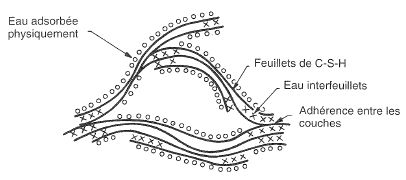
Modèles des silicates hydratés proposé par Feldman et Sereda (2)
Au sein même des C-S-H, l’eau est présente sous trois occurrences différentes :
L’eau hydroxyle (groupement OH) : liée aux atomes Si et Ca à la surface des feuillets.
L’eau interfoliaire (ou interfeuillet) : liée aux feuillets par des groupements
hydroxyles. Elle intervient alors dans la cohésion de la lamelle.
L’eau interlamellaire : fixée la surface des lamelles par un hydroxyle,
soit liée à d’autres molécules d’eau.
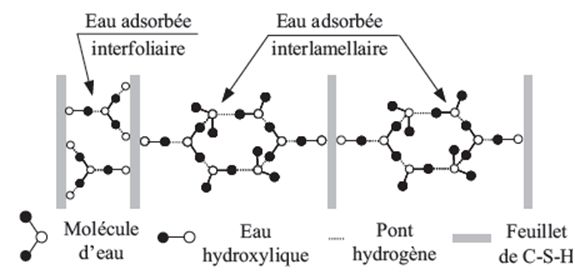
Etat de l’eau dans les C-S-H par Sierra, 1974, cité par Regourd. Schéma explicité par De Sa, 2007 (3)
Notes et… en savoir plus
Notre article : L’hydratation du ciment Portland
(1) Adam M. Neville, Propriétés des bétons, Eyrolles, 2000.
(2) R. F. Feldman, P. J. Sereda, A model of hydrated Portland Cement paste as deduced from sorption-length change and mechanical properties. Revue des Matériaux de Construction, 1968,n n° 6.
(3) Caroline De Sa, Etude hydro-mécanique et thermo-mécanique du béton. Influence des gradients et des incompatibilités. Thèse de l’ENS de Cachan, 2007.
Micheline Regourd, Le béton hydraulique connaissance et pratique, Presse de l’ENPC, 1982, chapitre sur l’eau et chapitre sur l’hydratation.
Husam Mitani, Variations volumiques des matrices cimentaires aux très jeunes âges : approche expérimentale des aspects physiques et microstructuraux. Thèse de l’ENPC, 2003.
