La plupart des propriétés du béton, et plusieurs aspects de sa durabilité dépendent des caractéristiques de la pâte de ciment durci. Il est donc important de comprendre la structure de la pâte de ciment hydraté (voir aussi, à ce sujet l’article de Nourredine Rafaï : La matrice cimentaire).
La prise du ciment n’est pas un séchage de la pâte après ajout de l’eau ; il s’agit d’un ensemble de réactions chimiques d’hydratation permettant le passage de la pâte de ciment (ciment additionné d’eau) de l’état liquide à l’état solide.
La pâte de ciment hydraté est le résultat de réactions chimiques entre l’eau et les composés du ciment. Il s’agit d’un processus complexe dans lequel les principaux composés du ciment C3S, C2S, C3A, et C4AF réagissent pour former de nouveaux composés insolubles qui entraînent la prise et le durcissement progressif du matériau.
L’étude des réactions d’hydratation des composants du ciment dissocie artificiellement des mécanismes dont le déroulement est, dans les faits, simultané.
Hydratation des silicates
Au contact de l’eau, les silicates tricalciques (Ca3SiO5) et les silicates bicalciques (Ca2SiO4) se dissolvent sous forme d’ions qui interagissent entre eux et forment des silicates de calcium hydratés (C-S-H) et de la portlandite (Ca(OH)2). Ces réactions sont exothermiques et peuvent servir de catalyseur à la réaction d’hydratation. Dans le cas du C2S, la cinétique d’hydratation est plus lente et la quantité de Portlandite formée est plus faible.
Les C-S-H sont des composés non cristallins. Ils ont les caractéristiques d’un gel et possèdent une composition variable, leur formule générale est la suivante :
(CaO)x(SiO4)y(H2 O)z avec 0.6 < x/y < 2 et 1 < z < 4.
Leur composition moyenne est proche de (CaO)1.7(SiO4)(H2O)4 .
L’enchevêtrement du gel C-S-H donne sa solidité au ciment : les C-S-H se développent à la surface des grains de ciment non hydratés et comblent progressivement les interstices capillaires entre les grains.
Au bout de quelques heures, la couche d’hydrates qui enrobe les grains de ciment devient assez épaisse pour ralentir la diffusion des ions et de l’eau vers les composants anhydres du système. L’hydratation ralentit de plus en plus, mais peut se poursuivre pendant des mois voire des années.
Hydratation des aluminates
L’aluminate tricalcique est le composé du ciment le plus réactif avec l’eau. C’est parce que l’hydratation des aluminates est très rapide que les cimentiers ajoutent du gypse au clinker pour contrôler ces réactions. Les réactions avec les aluminates s’effectuent en plusieurs étapes :
Étape 1 : Formation d’ettringite (phase AFt)
Les aluminates réagissent avec le sulfate du gypse pour former de l’ettringite TSA (trisulfoaluminate de calcium hydraté). : ((CaO)6 (Al2O3)(SO3)3, 32H2O). Cette réaction est fortement exothermique. Une couche d’hydrates vient entourer les aluminates qui forment alors une couche protectrice autour du grain.
Étape 2 : Transformation de l’ettringite en monosulfate de calcium hydraté
Lorsque le gypse est épuisé, la concentration en sulfates de la solution baisse. L’ettringite devient alors instable et se dissout pour former du monosulfate de calcium hydraté (appelé AFm) : ((CaO)3(Al2O3)(CaSO4), 12H2O). Les réactions chimiques s’intensifient.
Étape 3 : Hydratation des aluminates résiduels
Au bout de quelques semaines, en général, l’ettringite se transforme totalement en monosulfo-aluminate. Au-delà d’un mois, les réactions se poursuivent lentement avec l’aluminate (C3A) et l’aluminoferrite (C4AF) pour former de l’aluminoferrite de calcium hydraté. Même si les séquences réactionnelles sont proches du C3A, l’aluminoferrite tétracalcique (C4AF) est nettement plus lent à réagir et n’apparaît de manière significative qu’une fois que le gypse est totalement épuisé.
Mécanismes d’hydratation d’un ciment Portland
L’hydratation du ciment Portland implique, nous venons de le voir, la réaction des quatre phases minérales qui le composent. Comme le ciment est composé principalement de C3S, c’est l’hydratation du C3S qui contrôle la cinétique globale de l’hydratation. Il existe cependant une synergie entre les différentes réactions.
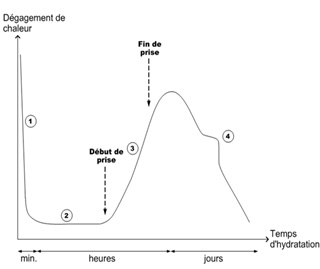
d’après Alexa Bresson, 2006
La Figure ?1 présente la courbe caractéristique de calorimétrie isotherme d’un ciment qui peut être découpée en quatre périodes :
Période 1 : réactions initiales
Cette période débute dès le contact entre l’eau et le ciment et dure quelques minutes. Le C3S et le C3A des grains de ciment réagissent immédiatement avec l’eau, formant de l’ettringite et des C-S-H (métastables) : les ions entrent en solution.
Période 2 : période dormante
Le dégagement de chaleur est faible. Aucune évolution de la pâte ne semble se produire. Les réactions chimiques ont pourtant commencé : des ions passent en solution dans l’eau durant cette phase (ions calcium, silicates, hydroxydes et sulfates). Quand l’eau de gâchage est saturée en ions, le début de la prise se produit. Le pH de la solution augmente, ce qui ralentit la dissolution des constituants.
Période 3 : période d’accélération
Cette période débute lorsque la concentration en ions Ca2+et OH– de la solution devient critique, la conductivité électrique de la solution étant alors à son maximum. Cette sursaturation induit la précipitation de la portlandite. Il s’ensuit alors les mécanismes de dissolution, de nucléation et de précipitation des différentes phases, permettant la formation des hydrates (ettringite, portlandite, C-S-H). Cette activité chimique dégage beaucoup de chaleur. Les hydrates formés commencent à s’enchevêtrer et créent donc un solide.
Période 4 : période de ralentissement
Les grains anhydres se trouvent recouverts d’une couche d’hydrates qui s’épaissit de plus en plus. Pour que l’hydratation se poursuive, il faut que l’eau diffuse à travers les pores de gel. La chaleur dégagée diminue.
Si le réseau poreux est fermé, une partie du ciment n’est jamais atteinte et donc ne sera jamais hydratée. C’est pendant cette période que l’ettringite de type AFt se dissout afin de se transformer en type AFm.
Les mécanismes complexes à l’origine de la création des différents produits de l’hydratation que sont les silicates et les aluminates sont l’adsorption, l’hydrolyse, la dissolution, la solvatation et la cristallisation.
