Tout le monde, ou presque, grâce à l’Eau de Javel et aux piscines municipales, connaît le chlore. Faisons connaissance un peu plus intimement avec cet élément singulier, omniprésent dans notre quotidien et, bien évidemment, dans les matériaux de construction qui nous entourent.
Définition
Le chlore est un élément chimique qui appartient au groupe des halogènes. Son symbole est Cl, et son numéro atomique est 17.
Le chlore et son identification (un peu d’histoire…)
C’est en 1774 que le chimiste suédois Carl Wilhelm découvre le chlore (qu’il nomme alors acide marin déphlogistiqué).
Le prenant pour un acide, il ne le considère pas comme un corps simple. Il l’obtient en faisant réagir du dioxyde de manganèse avec de l’acide chlorhydrique :
4 HCl + MnO2 ? MnCl2 + 2 H2O + Cl2
Berthollet travaillant auprès de Lavoisier à l’Académie des Sciences reprend dans un mémoire de 1785 le problème de Scheele.
Il considère que l’acide marin déphlogistiqué « ne présente pas les propriétés caractéristiques des autres acides et qu’à la rigueur, il ne doit pas être placé dans leur nombre ».
En 1809, Guyton de Morveau, Gay Lussac et Thénard, pressentent que cet acide ne contient pas d’oxygène, mais ils continuent de le tenir pour un corps composé.
C’est un pharmacien inconnu, François-René Curaudau qui démontre que ce gaz ne contient pas d’oxygène. Il lit son mémoire à l’Institut en mars 1810 :
« Considérations générales sur les propriétés du gaz muriatique oxygéné suivies d’expériences qui prouvent que ce gaz ne contient pas d’oxygène ».
Refusé à l’impression malgré la signature de rapporteurs comme Guyton de Morveau et Chaptal, Curaudau le fit imprimer lui-même.
Ce n’est qu’à la fin de 1810 que le chimiste anglais Humphrey Davy montre par des voies parallèles à celle de Curaudau la vraie nature de ce gaz qu’il nomme alors chlorine (du grec kloros, qui signifie vert pâle). Davy, en montrant, par la même occasion, que l’acide chlorydrique ne contient pas d’oxygène, infirme la conception de Lavoisier selon laquelle les acides en comportent tous, affirmation qui avait induit Berthollet en erreur dans son étude du chlore…
La Communication de H. Davy à la Société Royale :
“On a Combination of Oxymuriatic Gas and Oxygene Gas”Philosophical Transactions of the Royal Society vol. 101, pp. 155-162 (1811), read February 21, 1811
A l’état élémentaire, les atomes s’associent en molécules diatomiques, le dichlore (Cl2) qui, aux conditions ambiantes de température et de pression, se présente sous la forme d’un gaz jaunâtre suffocant. On ne trouve le chlore dans la nature que sous sa forme ionique de chlorure.
Ceci mérite quelques explications…
Particularité du groupe des halogènes. Les atomes de cette famille possèdent 7 électrons sur leur couche électronique externe ou couche de valence.
Ces atomes, pour suivre la règle de l’octet, complètent leur couche de covalence. C’est-à-dire que les atomes réagissent entre eux pour prendre, perdre (liaison ionique) ou mutualiser des électrons (liaison covalente) de façon à avoir 8 électrons dans leur couche de covalence et atteindre ainsi la stabilité.
Tableau périodique des éléments (Wikipédia)
L’électronégativité des halogènes, c’est-à-dire leur capacité à attirer des électrons lors d’une liaison chimique, est élevée. Dans le tableau de classification périodique des éléments, l’électronégativité croit de gauche à droite du tableau pour les périodes (colonnes 1 à 18) et de bas en haut pour les groupes (lignes 1 à 7). Plus la différence d’électronégativité entre les atomes est élevée, plus la liaison est forte, de type ionique ; moins elle est élevée, moins la liaison est forte, de type covalente.
L’examen du tableau de classification périodique des éléments permet donc de voir que les halogènes, et le chlore en particulier, présentent une électronégativité élevée et sont donc susceptibles de former des composés avec de nombreux autres éléments, notamment avec les métaux alcalins du groupe 1 et les métaux alcalino-terreux du groupe 2, dont l’électronégativité est faible.
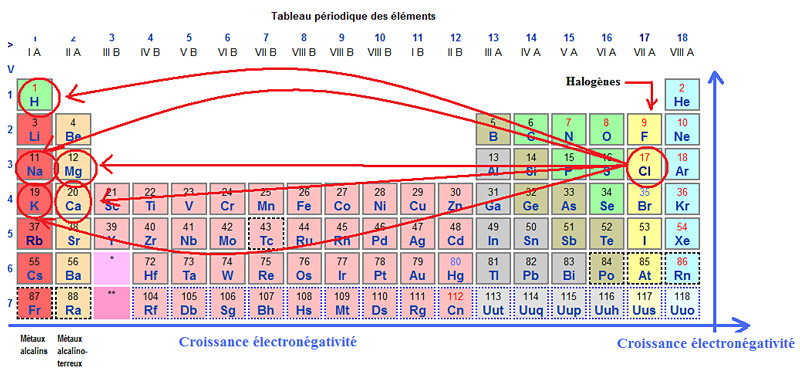
Liaisons ioniques possibles du chlore avec les métaux alcalins et alcalino-terreux
Liaison ionique et chlorures
L’ionisation, c’est-à-dire la perte ou le gain d’électron avec l’apparition d’atome de charge non nulle (ion) pour satisfaire à la règle de l’octet, donne lieu à la liaison ionique : liaison existant entre ions porteurs de charges de signes opposés. Les métaux alcalins et les halogènes forment le plus facilement ces ions, car tous deux acquièrent ainsi la configuration électronique d’un gaz rare (possédant 8 électrons sur leur couche de covalence).
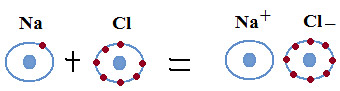
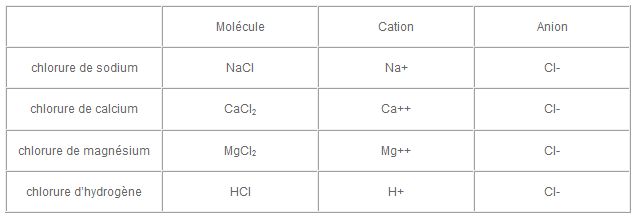
Cette liaison ionique, pour le chlore, donne des chlorures, qui sont constitués d’un cation et d’un anion, l’anion ayant capté un ou plusieurs électrons et étant de charge électrique négative (le nombre d’électrons étant supérieur au nombre de protons du noyau), le cation au contraire ayant cédé un ou plusieurs électrons et étant de charge électrique négative (le nombre d’électrons étant inférieur au nombre de protons du noyau). Dans cette lettre d’information nous nous intéresserons particulièrement à l’association du chlore avec le sodium, le potassium, le calcium et le magnésium pour donner naissance à des sels ubiquistes dans la nature, ainsi qu’à une association particulière, le chlorure d’hydrogène (acide chlorhydrique).
Sous la forme de chlorures, le chlore est ainsi très abondant sur terre, notamment sous la forme de chlorure de sodium (ou sel de table) dont les réserves sont immenses, depuis le sel gemme (sel d’origine terrestre ou Halite) jusqu’au sel marin, dissous dans les océans et les mers. Le chlore n’existant sur terre que combiné à d’autres éléments, sa production se fait à partir de l’électrolyse d’une solution aqueuse de chlorure de sodium : le chlore (Cl2) se dégage à l’anode et l’eau est décomposée à la cathode en hydrogène (qui se dégage) et en ions hydroxyde (OH–), ce qui forme progressivement une solution de soude (NaOH).
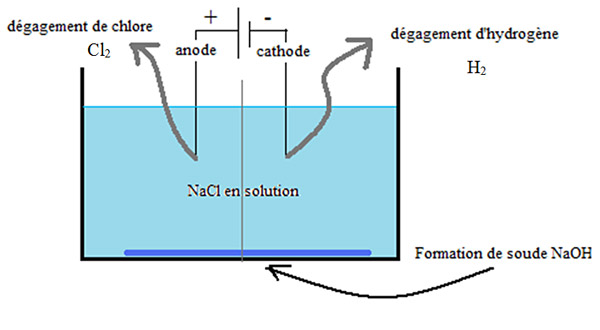
Schéma simplifié de l’électrolyse du chlorure de sodium
Se reporter aux articles :
chlorure de sodium
chlorure de calcium
chlorure de magnésium
 Retour à l’eau de Javel
Retour à l’eau de Javel
L’eau de Javel (NaClO) est obtenue à partir d’une solution électrolysée de chlore (Cl2 ) et de soude (hydroxyde de sodium : NaOH) :
Cl2 + 2 NaOH ? NaCl + NaClO + H2O
Elle contient donc également du chlorure de sodium résultant de sa fabrication.
Historiquement, c’est d’abord à partir d’acide chlorhydrique (« acide muriatique oxygéné », selon l’appellation de l’époque) et d’hypochlorite de potassium que l’eau de Javel est mise au point par Berthollet chimiste français en charge des teintures à la manufacture des Gobelins. Il cherche un procédé de blanchiment des toiles plus rapide qu’ « une longue exposition sur les prés ». L’eau de Javel s’appelle alors la lessive de Berthollet. C’est en 1820 que Antoine Germain Labarraque, pharmacien, remplace le potassium par le calcium. L’eau de Javel tire finalement son nom du quartier parisien où, du temps de Berthollet même, les ateliers de production de cette « lessive » nouvelle étaient installés.
Bibliographie :
Le livre de Berthollet : Amédée B. Berthollet, Eléments de l’art de la teinture, avec une description du blanchiment par l’acide muriatique oxigéné, Volume 1, Firmin-Didot, 1804, 2e éd. A consulter en ligne sur le site de la Bibliothèque Nationale.