 © Alain Lagrave
© Alain Lagrave
L’eau est le seul corps qui existe sous les trois états solide, liquide et gazeux aux conditions que l’on rencontre sur la Terre. Cette singularité est accompagnée d’anomalies au regard de ce que la chimie nous enseigne sur des composés chimiques analogues : son point d’ébullition, son point de fusion, sa chaleur de vaporisation et sa tension superficielle sont anormalement élevés.
L’ensemble de ces propriétés suggèrent que sa cohésion est importante et qu’il existe donc un lien fort entre les molécules d’eau.
Autre motif d’étonnement : contrairement à la normale pour les fluides, l’eau liquide est plus dense que l’eau solide, si bien que la glace flotte.
Enfin, la constante diélectrique de l’eau est, elle aussi, anormalement élevée.
Qu’est-ce qui commande donc à cette chaîne d’excentricités que présente l’eau ?
La molécule d’eau
L’eau est un corps dont l’unité de base est une molécule, notée H2O, formée d’un atome d’oxygène relié à deux atomes d’hydrogène par des liaisons covalentes: chaque atome d’hydrogène partage ainsi avec l’atome d’oxygène une paire d’électrons. L’assemblage d’atomes obtenu est non linéaire, formant un coude dans l’assemblage de H2O : c’est la raison de la polarité de la molécule d’eau.
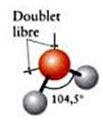
Représentation de la molécule d’eau
Source : P. Atkins, L. Jones, de Boeck 1997
En savoir plus : Sur la décomposition de l’eau par Lavoisier et la naissance de la chimie moderne, voir notre article
Dipolarité de la molécule d’eau
En fonction de la nature et donc de l’électronégativité des atomes qui composent une molécule, des charges partielles
Charge partielle
Si le barycentre des charges positives et celui des charges négatives coïncident, la répartition des charges est symétrique et la molécule est qualifiée d’apolaire. Si les barycentres ne coïncident pas, il y a donc deux pôles distincts dans la molécule, dont les charges sont opposées.
Le moment dipolaire dans une molécule correspond au produit de la distance entre les pôles par la charge.
Il se trouve que, dans la molécule d’eau, l’atome d’oxygène présente une charge partielle négative alors que les deux atomes d’hydrogène présentent une charge partielle positive. Comme, d’autre part, dans la molécule d’eau, l’angle formé entre les deux tomes d’hydrogène par rapport à l’atome d’oxygène est ouvert (104,45°), leur distance est relativement grande. La molécule d’eau est donc fortement polaire. Les molécules d’eau se lient entre elles du fait de cette polarité : les atomes d’oxygène électronégatifs attirant les atomes d’hydrogène électropositifs. Cette liaison électrique est appelée liaison hydrogène.
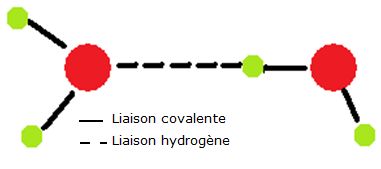
Représentation schématique de la liaison hydrogène
La liaison hydrogène
Pour ce qui concerne l’eau, la liaison hydrogène est donc une force intermoléculaire qui implique un atome d’hydrogène et un atome électronégatif, l’oxygène. L’eau joue pour elle-même le double rôle de donneur d’H et de récepteur d’H ; la possibilité d’établir 4 liaisons hydrogène par molécule d’eau rend puissante cette liaison intermoléculaire. C’est donc la liaison hydrogène qui rend compte des anomalies de l’eau en expliquant la force de sa cohésion intermoléculaire. La portée de cette liaison peut s’étendre à de grandes distances d’interaction et, dans les milieux condensés (liquide et solide), s’appliquer à tout le milieu.
Structure de la glace
Dans la structure cristalline de l’eau, chaque atome d’hydrogène se lie à un atome d’oxygène d’une molécule voisine pendant que ce même atome accepte une liaison hydrogène avec des H, liés de façon covalente à deux molécules d’eau distinctes. Les atomes d’hydrogène sont situés entre deux atomes d’oxygène et forment une liaison covalente avec l’un et une liaison hydrogène avec l’autre.
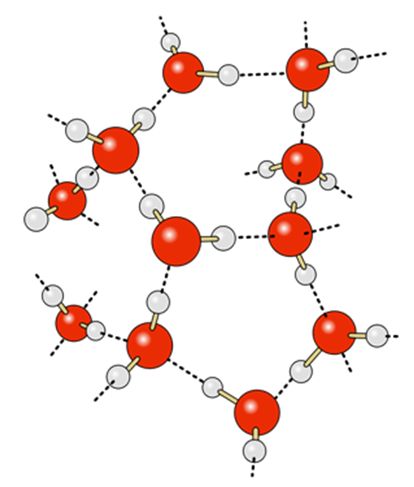
Structure cristalline de la glace
Source : http://acces.ens-lyon.fr/acces/terre/eau/comprendre/proprietes-physico-chimique-de-leau
En établissant ces liaisons hydrogène, les molécules d’eau s’organisent selon une disposition spatiale et une directionnalité qui structure un réseau hexagonal incluant un grand nombre de vides entres les molécules associées. C‘est cette propriété qui permet la cristallisation de l’eau sous les conditions que l’on connait : expansion de volume et moindre densité qui permet à la glace de flotter.
La fusion de la glace entraînera la rupture de liaisons hydrogène de telle sorte que les molécules d’eau liquides plus proches les unes des autres rendront celle-ci plus dense que sa forme solide. C’est à la température de 4° C que l’eau liquide connaît le maximum de sa densité.
Structure de l’eau liquide : la fluidité
L’état liquide est le plus complexe des états de la matière. Pour l’eau, on a d’ailleurs remarqué, autre anomalie, que ce liquide devrait être un gaz à la température ambiante ; en effet, l’énergie moyenne d’une liaison hydrogène entre deux molécules voisines est de l’ordre de trois fois supérieure à celle produite par l’agitation thermique. Cette phase liquide est particulièrement importante, dans la mesure où elle conditionne une grande partie de la chimie et où toute la biochimie s’y déroule.
On a tâché de décrire la structure de l’eau liquide par de nombreux modèles qui permettent de rendre compte de ses singulières propriétés physiques. On admet que, du fait de l’élévation de la température, un certain nombre des liaisons hydrogène de sa forme cristalline se rompent. Sous forme fluide, les molécules d’eau sont donc regroupées par grappes du fait de liaisons hydrogènes maintenues au milieu de molécules libres dont le nombre croit avec la température.
Dans cet état, l’orientation des liaisons hydrogène n’est pas idéale. Comme l’espace autour d’un atome d’oxygène n’est plus strictement déterminé par 4 atomes d’hydrogène, il peut être occupé par des molécules orientées au hasard. Les liaisons hydrogènes restantes forment dès lors un réseau statistique où, dans le désordre apparent, persiste l’organisation tétraédrique des liaisons.
Chaque molécule d’eau participe aux liaisons hydrogène de façon statistique. Le réseau de ces relations est donc constamment renouvelé : en moyenne, toute les 10 ps (1ps =10-12 s) une molécule d’eau réorganise ses relations avec les molécules voisines. Dans l’eau liquide, il existe donc toujours une structure locale instantanée.
Polarité et solvatation : l’eau est un solvant
La nature polaire de l’eau fait de l’eau liquide un puissant solvant des substances ionisables et des substances polaires. L’eau dissout rapidement le réseau cristallin des sels en dépit des fortes interactions électrostatiques entre ions positifs et négatifs, en raison des propres intéractions entre les molécules dipolaires de l’eau avec les ions pour former des enveloppes d’hydratation. Ces dernières isolent ces ions, on dit alors qu’ils sont solvatés.
Si les molécules du solvant entourent le soluté, c’est que les interactions solvant-soluté sont suffisamment stables : la molécule d’eau est fixée par le champ de forces électrostatique généré par le soluté pendant un temps beaucoup plus long (plusieurs centaines de fois) que celui de la réorganisation de ses propres liaisons hydrogène. La structure des enveloppes d’hydratation est donc à la fois stable et dynamique.
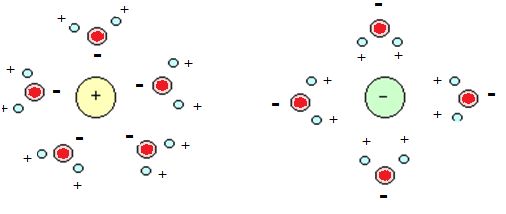
Représentation schématique de la solvatation par des molécules d’eau
En savoir plus
Loretta Jones, Peter William Atkins, Chimie : Molécules, matière, métamorphoses. De Boeck, 1998
Sur la décomposition de l’eau par Lavoisier et la naissance de la chimie moderne, voir notre article
